Wie Proteinkomplexe Muskelfasern stabilisieren: RUB-Forscher finden gleichen Mechanismus wie in DNA
Archivmeldung vom 19.01.2012
Bitte beachten Sie, dass die Meldung den Stand der Dinge zum Zeitpunkt ihrer Veröffentlichung am 19.01.2012 wiedergibt. Eventuelle in der Zwischenzeit veränderte Sachverhalte bleiben daher unberücksichtigt.
Freigeschaltet durch Thorsten Schmitt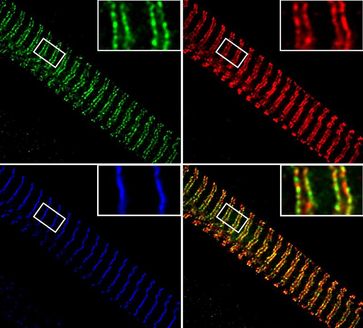
Der gleiche Mechanismus, der die Erbsubstanz im Zellkern stabilisiert, ist auch für die Struktur und Funktion von Muskelzellen der Wirbeltiere entscheidend. Das haben RUB-Forscher um Prof. Dr. Wolfgang Linke (Institut für Physiologie) in Kooperation mit amerikanischen und deutschen Kolleginnen und Kollegen nachgewiesen. Ein Enzym heftet eine Methylgruppe an das Protein Hsp90, das daraufhin einen Komplex mit dem Muskelprotein Titin bildet. Störten die Forscher dieses Proteinnetzwerk durch genetische Manipulation bei Zebrafischen, löste sich die Muskelstruktur teilweise auf. Die Wissenschaftler zeigten damit, dass die Methylierung auch außerhalb des Zellkerns bedeutend ist.
Ihre Ergebnisse veröffentlichten sie in Genes and Development.
Methylierung im Zellkern
Enzyme, genannt Methyltransferasen, übertragen im Zellkern Methyl (CH3)-Gruppen auf bestimmte Abschnitte der Erbsubstanz. So markieren sie aktive und inaktive Abschnitte der Gene. Auch Zellkernproteine werden methyliert, am häufigsten an der Aminosäure Lysin. An den methylierten Regionen bilden sich Proteinkomplexe, die zum Beispiel wichtig für Reparatur und Replikation der Erbsubstanz sind. Methyltransferasen kommen aber nicht nur im Zellkern, sondern auch in der Zellflüssigkeit (Zytoplasma) vor. Bislang war jedoch weitgehend unbekannt, welche Proteine sie dort methylieren und wie sich die Methylierung funktional auswirkt.
Erstmals gezeigt: Methylierung im Zytoplasma fördert Proteinkomplexbildung
Die Forscher identifizierten zunächst ein Enzym, das hauptsächlich im Zytoplasma vorkommt und die Aminosäure Lysin methyliert (Smyd2). Anschließend bestimmten sie den Interaktionspartner des Enzyms Smyd2, der sich als das Hitzeschockprotein Hsp90 herausstellte. Die Wissenschaftler zeigten weiterhin, dass Smyd2 und methyliertes Hsp90 einen Komplex mit dem Muskelprotein Titin bilden. „Titin ist das größte Eiweiß des menschlichen Körpers und vor allem für seine Rolle als elastische Feder in Muskelzellen bekannt“, erklärt Linke. „Genau diese elastische Region des Titins wird durch die Bindung von methyliertem Hsp90 geschützt.“
Titin braucht Schutz durch methylierte Proteine
In Skelettmuskelzellen des Zebrafisches erforschte Linkes Team, was passiert wenn der Schutz durch das methylierte Hitzeschockprotein wegfällt. Gentechnisch veränderten sie den Organismus so, dass er das Enzym Smyd2 nicht mehr bildete, was die Methylierung von Hsp90 unmöglich machte. Ohne methyliertes Hsp90 war die elastische Titinregion instabil und die Muskelfunktion stark eingeschränkt; die sonst regelmäßige Muskelstruktur löste sich teilweise auf.
Quelle: Ruhr-Universität Bochum (idw)





